登录35斗
未来食物背后的科技魅力:合成万物、40亿美金的豆腐和转基因三文鱼
比起人造食品,我们还看到很多创新的生物技术企业正在利用基因编辑技术、生物合成技术去修改农作物、动物的基因来快速获取人类需要的产品。
也许是2018年太压抑了,继比大麻多一麻的天麻都被A股市场拿出来爆炒之后,无处可藏的洪荒之力再一次被人造肉释放了,勤奋的股民甚至扒出了华英农业10年前的招股书,豪赌下一个工业大麻行情。
医疗创新的意义是满足未被满足的临床需求,而谈到食品科技创新时,我们是否只能为了新而新,而忽略了食物本来的意义。
我们热衷科技,无论是人造奶还是人造肉,我们满怀的是对自身健康长寿的美好愿景,是对这个我们赖以生存世界千秋万代可持续发展的殷切期盼,这是所有人的初心,不忘记才能得始终。
立地食斋还是无肉不欢?
我们生而为兽,食物获取方式的变迁,让我们进而成人。祖先茹毛饮血的天性,早已刻在基因里,世代流传。
适不适合做个严格的素食者,先得看看我们身上的脂肪酸去饱和酶基因有没有一个极其重要的22个bp的插入突变(FADS2,Version D),可以通过提高不饱和脂肪酸合成酶的表达量来增加不饱和脂肪酸的合成效率。如果不具备这个突变,又不主动摄取自身无法合成但参与细胞构建的长链脂肪酸类物质,那无异于是作死。
FADS基因在人类种群中频率的变化,勾勒出一幅人类生存方式、社会演化的动态地图。在旧石器时代早期,人类靠少量狩猎和采集野果为主,FADS2基因频率稳定在30%左右。
当狩猎技术越来越成熟,人们食物中的肉类超过了野果,这时候曾经功能强悍的FADS2基因开始显得多余,等到旧石器时代结束的时候,自然选择已经大大降低了人类基因组里的FADS2的比例。
但当人类步入到农耕时代,植物的人为驯化和栽培进程推动了食物结构发生巨大变化,植物来源的食物占据了主要位置,FADS2的基因频率又逐渐升高并随着人类饮食结构的固定而趋于稳定。
FADS2的基因频率在中国人群里分布差异非常大,根据现有的数据,北方汉族人有65%的人携带这个基因,而南方的汉族人只有22%。
比起目前席卷全球的严格素食才是健康和可持续发展的生活方式的理念,我们是否有理由相信,就如同精准医疗正在日益深入人心的时候,人们其实更需要适合自己基因的独一无二的饮食方案,来实现精准营养的未来?
一个万物皆可合成的未来
肉之所以让人欲罢不能,是由于肉的质感和味道源于血红素(heme)。血红素使肉具有类似铁锈且带腥的味道(没错,就是血味儿),并且在烹调的过程中让蛋白质逐渐呈现焦糖并有独特的烟熏味道。
风头正劲的Beyond meet用甜菜色素染色,Impossible food在做植物肉上奉献了最大的诚意,Impossible food开创性的用酵母合成大豆根瘤来源的血红素添加到植物蛋白中,让素肉无论是在烹饪前还是在烹饪过程中都像极了真肉。
血红素除了增加人造肉的风味外,还有更加有意义的作用,即输血替代品。血红蛋白是人体必需的蛋白质,它通过血液将氧气输送到器官和组织。
近年来,人们越来越关注这种重要蛋白质在全球,特别是在欠发达国家由于自然灾害、战乱、捐助者数量减少、人口老龄化、恐怖袭击等造成的供应短缺问题。此外,常规输血还存在诸如血液传播病毒感染,如HIV和肝炎病毒等若干问题。
由微生物合成的重组血红蛋白,具有不依赖于献血者,不含有病毒,保存时间更长,可以实现稳定供应的优点。生物合成重组血红蛋白成为2018年世界卫生组织公布的千年重点发展项目之一。
虽然人类在探索血液替代品的道路上艰苦奋斗了近半个世纪仍收获甚微,但合成生物学和代谢工程的快速发展将为这一领域提供前所未有的机遇和强大的工具。
heme血红素生物合成途径
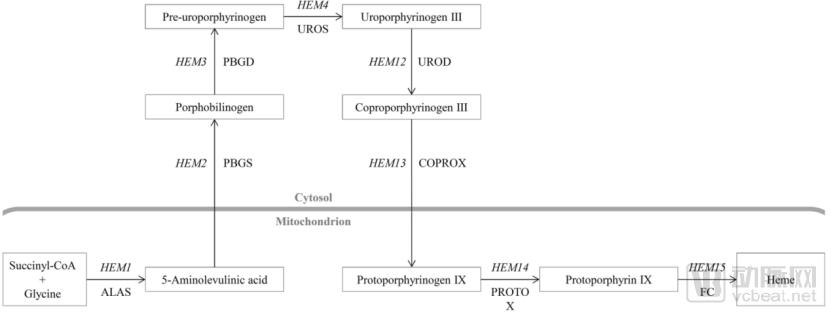
资料来源:Krainer, Florian W, et al. "Optimizing cofactor availability for the production of recombinant heme peroxidase in Pichia pastoris." Microbial Cell Factories 14.1(2015):4.
通过引入外源基因使某一生物合成其原来不能合成的新产品,这是一种常用的代谢工程手段。例如加州大学伯克利分校Jay Keasling课题组通过在酿酒酵母中引入及改造超过15个来自不同物种的基因,实现了大麻素及其非天然衍生物的生物全合成。
通过微生物细胞工厂合成植物来源的天然产物,其优点是微生物生长更快,单位时空内产量更高,可以通过较小的发酵工厂代替大面积的农业种植,大大降低生产成本。
在赋予了细胞新的合成能力,实现了从无到有的改造之后,代谢工程的下一个目标就是以最小的原料消耗生产最多的产品,最大程度地提高效率。
合成生命体往往具有高度复杂性,这决定了其需要海量的工程化试错性实验,即需要快速、低成本、多循环地完成“设计—构建—测试—学习”这一闭环。正如AI驱动的生物技术公司Zymergen的设想,利用机器人、大数据和机器学习来测试成千上万种菌株,这比传统的实验室方式快好几倍。
豆子引发的变革,最后还要回到豆子
以Beyond meat和Impossible food为代表的人造食品科技公司开创了一个科技与脑洞交织的时代,但是我们必须认清的是无论是Lab-grow meat(实验室培育肉)还是Plant based meat(植物蛋白替代肉)都是针对西方的饮食习惯与烹饪习惯发明的,不一定适合中国的消费市场,14亿人需要有中国自己的解决方式。
Impossible food公司一块成本接近40美金的素肉饼,实际上可以看做是兑了血红素的豆腐,在我们眼里市值超过40亿美金的Beyond meat公司的植物肉更是一块不折不扣的豆腐干了。
中国是世界上最早食用豆制品的国家,孙中山先生曾在《建国方略》中写到:以黄豆代肉类,中国人之发明。夫豆腐者,实植物中肉料也。此物有肉料之功,而无肉料之毒。
因此在追逐风口的同时,要回到我们已经吃了数千年的豆腐类产业链上去寻找和实践适合中国的发展点。
《中国农业产业发展报告2018》显示,2017年我国大豆总消费量11218万吨,是世界上最大的大豆消费国,而国内产量仅为1400万吨左右,进口金额位列进口农产品首位。
追溯历史,1995年之前,拥有5000年大豆(菽)栽培历史的中国还是世界上最主要的大豆出口国,但从2000年开始在我国转基因大豆没有实现产业化和国际贸易格局变化的大背景下,我国迅速成为全球最大的大豆进口国。
时至今日,站在家国情怀的角度一味地去对抗和抵制进口的转基因大豆是不现实和不理智的。
从市场角度讲,国产大豆和进口转基因大豆已经不是同一商品,它们分属两个不同的市场。国产大豆蛋白含量高,在食用市场(豆腐、豆浆、豆芽、发酵类大豆、分离蛋白等)有独特优势,而进口大豆主要补充食用油和饲料蛋白的缺口。寻求国产大豆与进口大豆的错位竞争才是未来大豆相关企业努力的方向。
颠覆杀戮,
除了吃素,还可以把牛“养”在瓶子里?
传统畜牧导致地球变暖无需赘述,而把动物剥皮开膛送上餐桌的行为又在很多文化中被看做是野蛮与文明倒退。
最现实的原因是现代社会人们只会食用动物的个别部位,势必会造成极大的浪费与潜在污染。
早在1931年,尚未成为首相的温斯顿·丘吉尔就曾预言:未来我们将不再为了吃鸡胸肉或鸡而非得养一只鸡,可以在适当的介质中培养需要的部分。
从上世纪50年代开始荷兰医生威廉·范艾伦就意识到了用动物细胞培养人造肉的可能性,在折腾了将近40年后他最终在1999年率先取得了运用细胞培养法进行肉类工业生产的技术专利。
然而在烧光200万来自荷兰政府的资助后,艾伦并没有真正做出人造肉。先驱成了先烈,但也为后人趟出了一条路,也推动荷兰成为人造肉技术与产业的发源地,也许这就是科学的魅力和科学家的意志,一代代人前仆后继,在看似天方夜谭的领域不断尝试与探索,才能成就今天的产业风口。
艾伦博士失败13年后,荷兰马斯特里赫特大学的科学家马克·波斯特博士,终于在全球首次成功培育出了人造肉。2013年,马克·波斯特创立了全球最早的Lab-grow meat公司Mosa Meat。
可以想象,未来我们从动物身上无创提取细胞,投入培养基,静静等待便可以收获一大块鸡胸肉和牛里脊,取炭火三分熟烤之,面朝大海,春暖花开。
看似美好,但具体实施起来却困难重重。比如大多数实验室用的都是胎牛血清作为组织培养基,除胎牛血清(Fetal Bovine Serum,是在屠宰怀孕母牛的时候,通过穿刺采血获取的胎牛的血清)本身极其昂贵外(50-200美元/L),采用该方式获得的人造肉本就违背了维护动物福利的初衷。
长远来看,寻找替代培养基解决方案才是Lab-grow meat最终实现产业化的关键所在。
目前只有来自以色列的Future Meat Technologies公司采用纯植物培养液的解决方案,此外他们还开发了模拟动物肝脏和肾脏的循环机制,能够让培养基实现循环使用来降低成本。
除生产成本外,在进行动物细胞培养时,培养基极易受微生物的污染,通常会选择在培养基中加入防腐剂和抗生素,这样培养出来的肉是否更安全和更环保,还有待论证。
而且,还有很重要的一点:目前所有的人造肉产品,都只能是碎肉。我们吃鸡腿牛排时那种肉质丰满的感觉,是通过动物在生长发育过程中活动和营养的复杂系统工程实现的,实验室培养肉暂时无法实现这种特性。
风口无需山寨,回归需求,亦是榜样的力量
我们相信后人在撰写科技史时,一定会把2019年标记为农业食品科技产业爆发的元年。除了人造肉企业大放异彩之外,其他领域的颠覆式创新也在改写整个行业的格局。
在满足人类口腹之欲的道路上,科学家们奉献了极大的兴趣和实践,2019年3月8日,美国FDA解除了禁止AquAdvantage转基因三文鱼的鱼卵以及由这种三文鱼制成的任何食品的进口警报。
为了这一天,AquAdvantage公司已经努力了25年。AquAdvantage三文鱼的“本体”是大西洋三文鱼,但它体内有一个基因来自大鳞大马哈鱼。这个基因并没有改变它们的生长激素的类型,只是提高了分泌水平;它也没有对最终的鱼肉产生影响,只是让鱼更快地生长到成年体型。
另外,大西洋三文鱼体内还有一个来自美洲绵鳚的启动子——一个分子开关,用来调节生长激素的合成。
这项技术其实早在1989年就诞生了——那时加拿大的加斯·弗莱彻博士和他的研究组首次实现了改变大西洋三文鱼的生长激素调节方式,使得它们能够全年生长,而不仅仅在春季和夏季生长。基因改造过的三文鱼仅需18个月便能长成进行销售,而常规三文鱼需要至少三年。
转基因三文鱼生长曲线
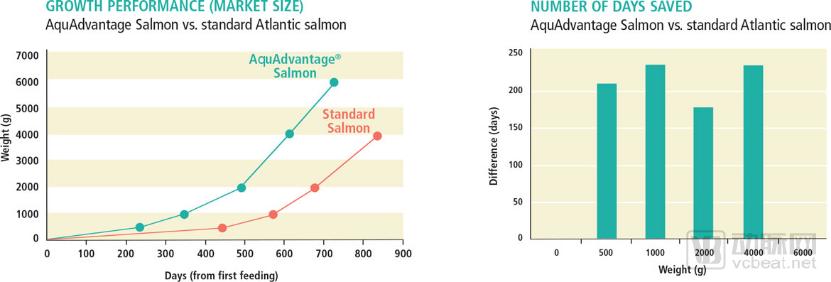
来源:AquAdvantage官网
比起人造食品,我们还看到很多创新的生物技术企业正在利用基因编辑技术、生物合成技术去修改农作物、动物的基因来快速获取人类需要的产品。
比如土豆在冷藏过程中,淀粉会缓慢分解成蔗糖、葡萄糖和果糖,之后如果要进行油炸的话,糖类在高温下分解成一种致癌物丙烯酰胺。而Calyxt公司利用基因编辑技术破坏土豆基因组中的一个控制淀粉分解的基因,这样就可以减少致癌物的产生。
2019年3月1日,Calyxt公司的基因编辑大豆油开始在美国上市销售,该大豆油油酸含量高达80%,且不含有反式脂肪酸,是我们梦寐以求的健康食用油。
除了基因编辑大豆外,Calyxt公司还在通过基因编辑技术来开发更健康的生物技术食品成分和农作物新品种。
Calyxt公司研发管线

来源:Calyxt官网
榜样的力量让我们看到了更多可能,基因编辑技术的产业化前景中,医学是重要领域,但需要更长的路。
基因编辑在非医疗领域的应用主要集中在农业、能源化工生产、物种控制、科研等领域,离我们最近的当属农业。
比如我们对优质农产品的多重要求,要靠多基因位点的编辑实现;再比如许多植物通常有好几套染色体,改变一个基因需要批量处理它在多个染色体上的拷贝,而这些正是这项技术独有的能力。
和传统的转基因方法不同,目前大多数 CRISPR 技术在农业改良上的应用都是对基因的敲除和单碱基水平的替换,并没有引入外源性的基因,与人类实践了数千年的杂交技术相比,这一技术可以使得植物育种过程中发生最小的生物学改变。
同时这一技术还可以使科学家回避那插入来自其他物种外源DNA技术(转基因)所带来的争议。纵观国外的大公司纷纷推出产品上市计划,再加上公众的接受过程和可能的 FDA 咨询过程,基于CRISPR 技术的创新农产品在2-3年就可能迎来上市的高峰。
我国在CRISPR 技术应用于农业方面的研究处在世界先进水平,2016年2月23日,国际著名技术评论期刊《麻省理工科技评论》公布了2016年十大技术突破。
中国科学院遗传与发育生物学研究所高彩霞研究员及其团队关于植物基因精准编辑技术的研发成果名列其中。
麻省理工科技评论指出,该技术能够精准、高效、低成本地进行植物基因组编辑,有望用于生物安全的作物遗传改良和定向育种,提高农业生产率,满足日益增长的人口需求。
高彩霞团队主要贡献在于建立成熟、高效的农作物基因精确编辑技术平台并对重要农作物的定向育种进行了成功的尝试,取得了一系列世界领先的成果。2013年,高彩霞团队率先利用CRISPR/Cas9系统对水稻和小麦的多个基因进行编辑,并且获得了世界上第一株基因编辑的植物。
2017年10月,中国农业大学联合中国科学院动物所的研究人员在PNAS发表论文,利用CRISPR/Cas9技术,向猪的基因组内插入一个解耦联蛋白基因(UCP1),要知道正是由于现代家猪的祖先在2000万年前就丢失了这个基因,才让猪越吃越胖。
经过基因改造的猪瘦肉率显著提高,不用添加瘦肉精,比正常猪脂肪少24%,猪的抗寒能力也得到提高。
颠覆与共生才是这个时代的基调,前沿技术进入传统行业的门槛从来都是理解行业本质的能力,就如同我们看《复联4》也是有门槛的,这门槛,不是专业知识,不是智力能力,它关于也只关于,你是否进入那个世界。
欢迎来到四千年农耕文明的未来世界。
注:文中如果涉及35斗记者采访的数据,均由受访者提供并确认。
声明:35斗所刊载内容之知识产权为35斗及相关权利人专属所有或持有。转载请联系gao.kp@vcbeat.net。
用户
反馈





